
《CT理论与应用研究》

水在结晶后体积变大。细胞水分在超低温下形成大的结晶会破坏细胞膜结构而导致细胞死亡。第一代植物超低温保存技术通过程序降温诱导胞外结晶而对细胞缓慢脱水,胞内液体浓度和粘稠度提升,在超低温下进入玻璃化状态,避免了胞内结晶而保证细胞存活。第一代超低温保存技术仅适用于耐冷植物。新的玻璃化超低温技术以高浓度的植物玻璃化溶液处理细胞,在渗透脱水同时,低温保护剂进入细胞内部改变了细胞液体的热力学性质,快速降温时可以实现胞内和胞外的玻璃化,保持细胞结构的完整和再生能力。新一代植物超低温保存技术实现了对热带植物的保存,大大拓展了植物超低温保存的范围。
细胞膜是低温伤害和渗透响应的核心部位。玻璃化超低温保存流程中,细胞经受了剧烈和复杂的渗透和温度变化,细胞的存活和死亡取决于细胞膜能否对上述胁迫做出有效响应。长期以来,细胞膜对超低温过程的响应机理没有得到解析,这也制约了超低温技术的进一步发展。近日,中国科学院昆明植物研究所种子生物学研究组等以木兰科植物厚朴的胚性细胞的超低温保存体系作为模型系统,采用脂类组学分析方法,比较了12个不同超低温处理的差异,揭示了细胞膜对玻璃化超低温保存过程的响应模式。结果显示,渗透保护处理和复水处理两个相对的过程,发生了磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)和磷脂酰肌酸(PA)和磷脂酰甘油(PG)的头基团互换,进行了细胞膜重塑。PVS溶液处理后,总脂水平显著升高,为细胞将要经历的冷冻过程储备了大量脂类分子。该研究结果表明,膜脂重塑和预防脂类降解是PVS方法成功的关键。从膜脂分子的角度对基于PVS的植物超低温机理进行了解析,为改进玻璃化超低温保存技术,拓展植物超低温保存的通用性和应用范围提供了新思路。上述研究成果以Lipid Remodeling Confers Osmotic Stress Tolerance to Embryogenic Cells during Cryopreservation为题,在线发表在International Journal of Molecular Sciences上。
该项研究工作得到国家自然科学基金、云南省应用基础研究项目、 云南地方学院联合基金、中国西南野生生物种质资源库“交叉合作团队”开放研究项目、山东省农业良种项目的资助。
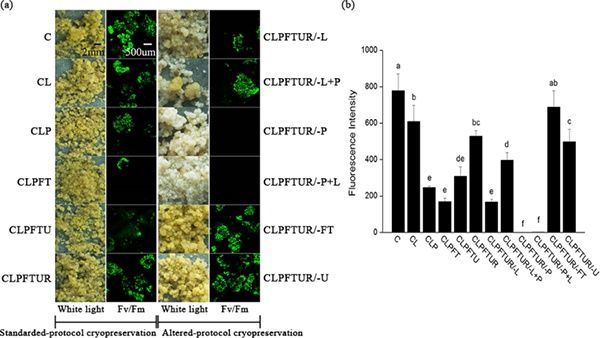
图1 厚朴胚性细胞在12个不同超低温处理后的成活率
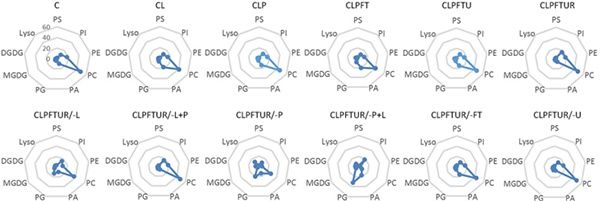
图2 厚朴胚性细胞在12个不同超低温处理后,膜脂分子的变化
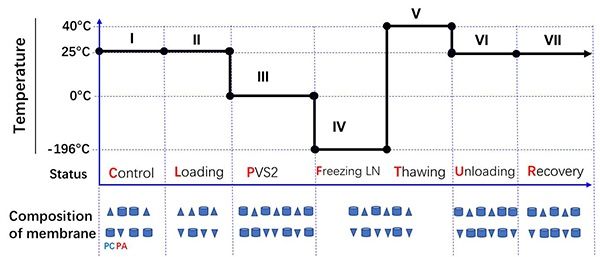
图3 厚朴胚性细胞超低温过程中膜脂分子组成的变化模型
【来源:昆明植物研究所】
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 邮箱地?/p>
上一篇:风雷公司主要承建的全国首家高原适应研究 康复
下一篇:没有了